Künstliche Befruchtung
"Künstliche Befruchtung"
Paare, die meist schon länger versuchen schwanger zu werden, dies aber bislang einfach nicht klappen wollte, nehmen häufig ärztliche Hilfe in Anspruch und entscheiden sich ggf. für eine "Künstliche Befruchtung". Das heißt, eine medizinisch unterstützte Befruchtung der Eizelle mit dem Samen des Mannes. Hierfür gibt es verschiedene Methoden und Techniken. Diese werden je nach Ausgangslage des Paares angewendet.
1. Insemination
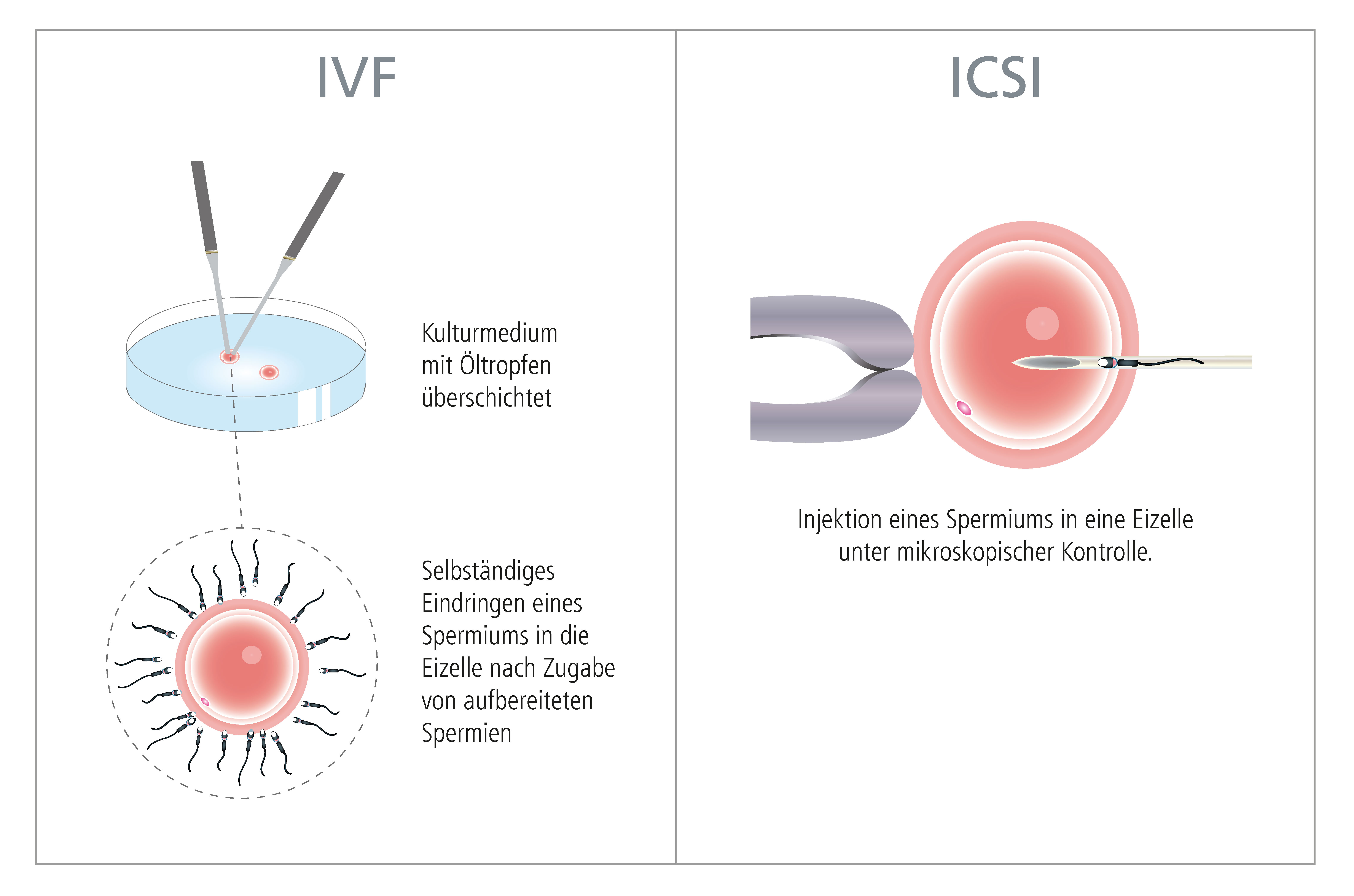
2. In Vitro Fertilisierung - IVF
3. ICSI
4. IMSI
5. Spezielle Techniken
1. Insemination
Die Intra-Uterine Insemination kann bei einer jungen Frau (bis zum 36. Lebensjahr) als erste Therapie-Option für 3 bis 6 Zyklen angeboten werden. Grundvoraussetzungen sind offene Eileiter bei der Frau und ein normaler Samenbefund (Spermiogramm) des Mannes. Unter diesen Voraussetzungen ist oft ein PCO-Syndrom der Frau die Ursache für den unerfüllten Kinderwunsch. In diesem Fall wird mit Hilfe von Follikel - stimulierenden Hormonen/Gonadotropinen oder auch mit Clomifen versucht, 1 bis 2 Follikel im Eierstock zur Reife zu bringen. Anschließend wird der Eisprung/Ovulation mittels hCG eingeleitet und der aufbereitete Samen in die Gebärmutterhöhle eingebracht. Die Spermien finden den Weg über die Eileiter zur Eizelle. Die Befruchtung der Eizelle mit einem einzigen Spermium findet normalerweise im obersten Teil des Eileiters statt. Anschließend beginnt die befruchtete Eizelle (Zygote) und der sich daraus entwickelnde Embryo eine 5-tägige Wanderung in die Gebärmutterhöhle. Im Blastozysten-Stadium erreicht diese anschließend die Gebärmutter und beginnt, sich in der Schleimhaut (Endometrium) einzunisten. Damit die Schleimhaut der Gebärmutter optimal für die Einnistung (Nidation/Implantation) vorbereitet ist, müssen gewisse Hormone (z.B. Progesteron) teilweise bis zum Zeitpunkt des Nachweises einer positiven Herzaktion 4 Wochen nach dem Eisprung oder bis zur 12ten Schwangerschaftswoche eingenommen werden.
2. In Vitro Fertilisierung - IVF
Seit 1978 besteht mit Hilfe der In vitro Fertilisierung mit anschließendem Embryotransfer eine therapeutische Möglichkeit, einem kinderlosen Paar auch bei verschlossenen Eileitern, diversen Hormonstörungen oder bei fehlendem Samen oder schlechter Samenqualität zu einem eigenen Kind zu verhelfen.
Grundsätzlich versteht man unter "In Vitro Fertilisierung" oder "extrakorporaler Befruchtung" die Vereinigung von Eizelle und Samenzelle außerhalb des Mutterleibs.
Dazu wird aus dem Eierstock die Eizelle entnommen und diese anschließend im Reagenzschälchen (= in vitro) mit dem Samen des Mannes zusammengebracht.
Die befruchtete Eizelle wird in einen Inkubator ("Brutschrank") gegeben, wo sie in einem speziellen Kulturmedium zum Embryo heranwächst (siehe "Blastozystenkultur"). Die Embryonalentwicklung kann mittels modernster Labortechnik sehr genau beobachtet und beurteilt werden. Hat der Embryo ein bestimmtes Entwicklungsstadium (Blastozyste = einnistungsfähiger Embryo) erreicht, wird dieser in die Gebärmutter der Frau eingebracht (siehe "Embryo-Transfer").
Solch eine Behandlung ist für das Elternpaar eine große Herausforderung. Aus diesem Grund sollte die Behandlung möglichst persönlich und in einer vertrauten Atmosphäre durchgeführt werden.
Das Paar muss über alle Aspekte der Therapiemöglichkeiten ausführlich informiert sein. Nach Durchsicht bereits vorhandener Befunde und einer gründlichen gynäkologischen Untersuchung, sowie der Kontrolle des Samens und der mitgebrachten Vorbefunde bzw. der noch zu erhebenden Befunde wird ein Therapieplan erstellt. In manchen Fällen erweist es sich als günstig, wenn eine psychologische Beratung (siehe "Emotionale Begleitung") angeboten wird und einer In vitro Fertilisierung vorangeht.
Eine genaue Beschreibung der einzelnen Untersuchungen (Ultraschall-Kontrollen, Hormon-Bestimmungen, Blutabnahmen, usw.) und Einzelheiten über die Medikation erhält jedes Paar in Form eines Merkblattes und eines Therapieplanes nach einer Vorbesprechung.
Die Behandlung erfolgt immer individuell und wird der jeweiligen Situation angepasst.
│ © 2021 Next Fertility IVF Prof. Zech
3. ICSI
Die sogenannte "Intracytoplasmische Spermieninjektion" (ICSI-Methode) hat sich 1992 als Meilenstein in der Reproduktionsmedizin etabliert. Mit Hilfe dieser Technik wird ein einzelnes Spermium direkt in die Eizelle injiziert, um damit eine Befruchtung zu erreichen. Damit kann Patienten-Paaren geholfen werden, bei denen die Ergebnisse des Spermiogramms auf eine eingeschränkte Fruchtbarkeit des Mannes hinweisen, z.B. wenn keine beweglichen Spermien im Ejakulat vorkommen. Oder in Situationen, wo durch Erkrankungen der ableitenden Samenwege keine Spermien im Samenerguss nachweisbar sind, kann aus dem Nebenhoden Samen entnommen und für die ICSI Methode verwendet werden. Es besteht auch die Möglichkeit, die Spermien direkt aus dem Hoden zu gewinnen (TESE/TESA).
│ © 2021 Next Fertility IVF Prof. Zech
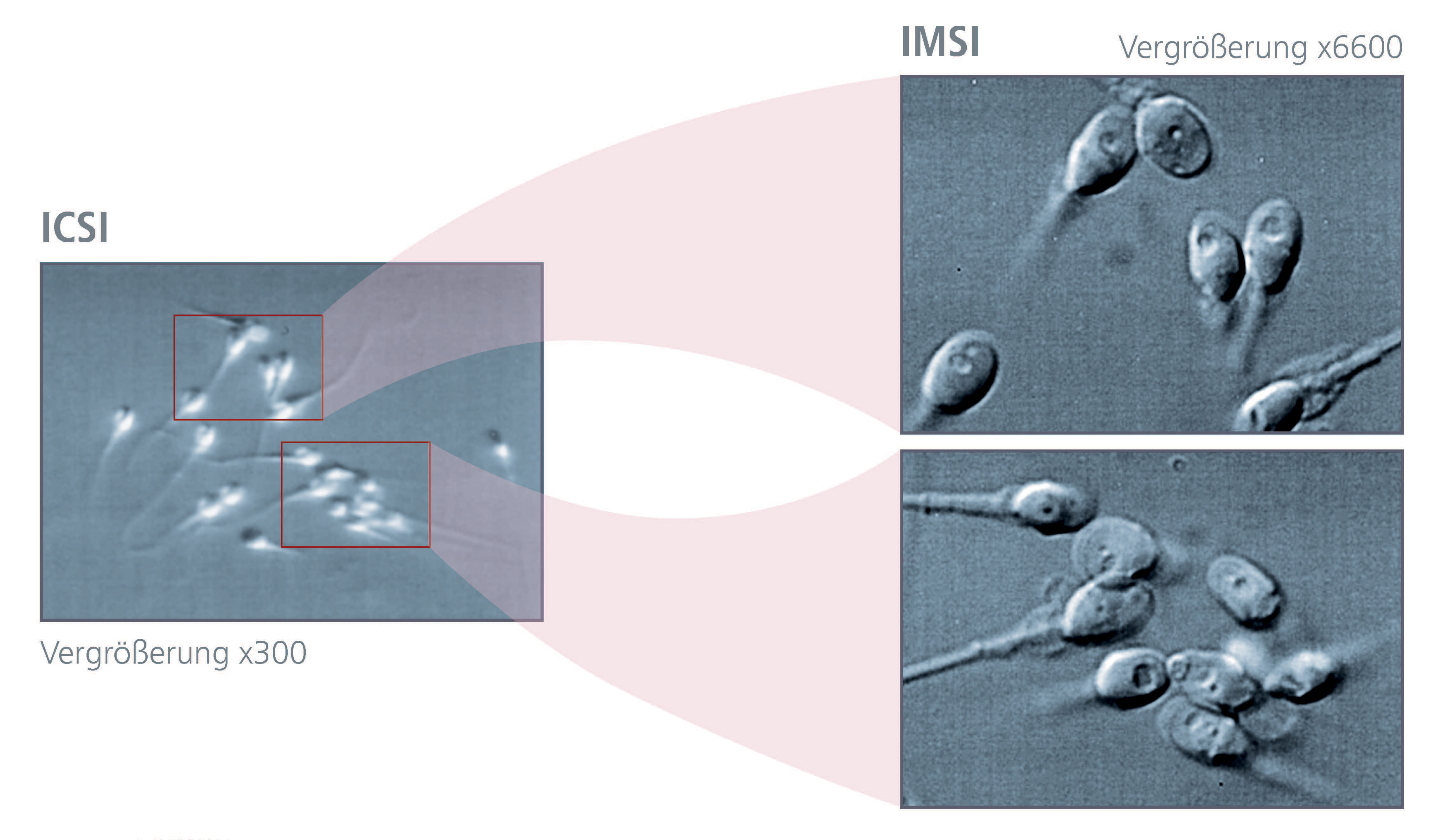
4. IMSI
Sowohl im natürlichen Zyklus, als auch bei der klassischen IVF (In vitro Fetilisierung) fungieren die Eizellhülle (Zona pellucida) und die vorhandenen Cumuluszellen als biologische Barriere, sodass in den meisten Fällen nur jene Spermien fähig sind eine Eizelle zu befruchten, welche auch die entsprechende Qualität aufweisen. Bei der vorher beschriebenen ICSI-Methode erfolgt die morphologische Beurteilung und Auswahl der Spermien (in der Regel bei 200-400x Vergrößerung) durch spezialiserte Biologinnen/Biologen. Die Qualität dieser Befundung und Auswahl kann durch Detailanalysen mittels hochauflösender Mikroskopiertechniken, wie die "Intrazytoplasmisch Morphologisch Selektierte Spermieninjektion" (IMSI), zusätzlich verbessert werden (siehe "Samenauswahl").
5. Spezielle Techniken
Spindel-Analyse
Die Spindel spielt eine zentrale Rolle in der meiotischen Reifung der menschlichen Eizelle (Oogenese). Sie ist für die sorgfältige Ausrichtung und Verteilung der Chromosomen während der Zellteilung verantwortlich. In 15-20% aller Fälle ist bei der reifen Eizelle vor der Befruchtung durch den Samen keine Spindel vorhanden. Das Vorhandensein einer Spindel ist, neben dem 1. Polkörper, ein genauer Indikator für die Eizellreife. Je älter die Frau, desto häufiger kommen solche Störungen der Spindel vor. Die Abwesenheit der Spindel ist mit einer deutlich reduzierten Befruchtungsrate und schlechter oder keiner Embryonalentwicklung in Relation zu setzen. Auch die Ausrichtung der Spindel während der ICSI/IMSI hat Einfluss auf die weitere Entwicklung der Embryonen. Normalerweise wird die Eizelle so orientiert, dass sich der 1. Polkörper bei 12h befindet und die Injektion der Samenzelle in die Eizelle bei 3h stattfindet. Wenn die Spindel nicht optimal ausgerichtet ist (meistens befindet sich die Spindel in der Nähe des 1. Polkörpers und somit auf Distanz von der Injektionsrichtung von Samen) und versehentlich durch die Injektion der Samenzelle mit der Glaskapillare getroffen wird, kann dies zu Störungen der Eizelle führen. Auch bei wiederholter Befruchtungs–Versagen kommt der Spindel–Analyse eine Bedeutung zu (individuell mit dem Arzt zu diskutieren).
Assisted Hatching - Schlüpfhilfe
Mit dieser Methode wird versucht, dem heranwachsenden Embryo das Schlüpfen (Hatching) aus der Eizellhülle (Zona pellucida) zu erleichtern. Die Eizellhülle wird mittels Laserstrahl "angeritzt". Dies ist vor allem dann sinnvoll, wenn die Eizellhülle zu dick (erkennbar mit der sog. Polarisationsmikroskopie und mit normalem Licht-Mikroskop) oder zu rigide erscheint. Vor allem mit zunehmendem Alter der Frau, werden die Eizellhüllen dicker und rigider, ebenso nach dem Tiefgefrieren und Wiederauftauen von Embryonen. Diese Technik wird je nach Befund in unseren IVF-Labors sehr individuell eingesetzt.
PICSI
PICSI ist eine Methode zur Auswahl reifer Spermien im Rahmen der ICSI/IMSI. Die Köpfe reifer Spermien tragen einen spezifischen Rezeptor für Hyaluronsäure (Hyaluronan). Hyaluronan ist eine wesentliche Komponente der Hülle, welche die Eizelle umgibt. Unreife Spermien verfügen nicht über diesen Rezeptor. Durch den sogenannten Hyaluronan-Bindungstest (PICSI) wird Hyluronan genutzt, um unreife von reifen Spermien zu trennen. Diese gebundenen Spermien können für die ICSI/IMSI verwendet werden. Diese Technologie kommt nur in ganz bestimmten Fällen zum Einsatz. PICSI kann die IMSI-Technik nicht ersetzten, lediglich in gewissen Fällen ergänzen.
Polarisationsmikroskopie
Die Eizellhülle (Zona pellucida) besteht aus 3 Schichten von Glykoproteinen und umhüllt die Eizelle bzw. den Embryo so lange, bis dieser aus der Hülle schlüpft. Dies geschieht am Tag 5-6 der Embryogenese im Blastozystenstadium. Mittels Polarisationsmikroskopie kann die Eizellhülle bezüglich Dicke aller drei Schichten beurteilt werden. Diese Daten erlauben eine bessere Bestimmung der Qualität der Hülle von Eizellen (oder Embryonen). Vor allem die innere Schicht der Eizellhülle scheint ein wichtiger nicht-invasiver Marker für das Entwicklungspotential einer Eizelle zu sein.
Medizinisches Erstgespräch
Den Ursachen für die Unfruchtbarkeit bei der Frau/beim Mann entsprechend gibt es unterschiedliche Therapie-Möglichkeiten. Welche Behandlung schlussendlich zielführend ist, wird im persönlichen Arztgespräch geklärt.